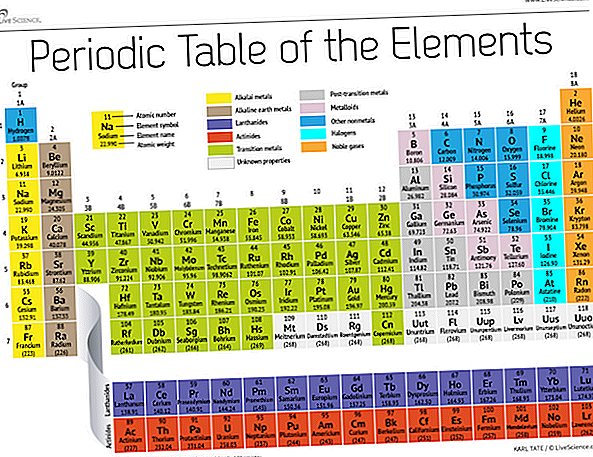
A fines del siglo XIX, el químico ruso Dmitri Mendeleev publicó su primer intento de agrupar elementos químicos de acuerdo con sus pesos atómicos. Solo se conocían unos 60 elementos en ese momento, pero Mendeleev se dio cuenta de que cuando los elementos se organizaban por peso, ciertos tipos de elementos ocurrían en intervalos o períodos regulares.
Hoy, 150 años después, los químicos reconocen oficialmente 118 elementos (después de la adición de cuatro recién llegados en 2016) y aún usan la tabla periódica de elementos de Mendeleev para organizarlos. La tabla comienza con el átomo más simple, el hidrógeno, y luego organiza el resto de los elementos por número atómico, que es el número de protones que contiene cada uno. Con un puñado de excepciones, el orden de los elementos se corresponde con la masa creciente de cada átomo.
La tabla tiene siete filas y 18 columnas. Cada fila representa un período; El número de período de un elemento indica cuántos de sus niveles de energía contienen electrones. El sodio, por ejemplo, se encuentra en el tercer período, lo que significa que un átomo de sodio generalmente tiene electrones en los primeros tres niveles de energía. Bajando la tabla, los períodos son más largos porque se necesitan más electrones para llenar los niveles externos más grandes y complejos.
Las columnas de la tabla representan grupos o familias de elementos. Los elementos en un grupo a menudo se ven y se comportan de manera similar, porque tienen la misma cantidad de electrones en su capa más externa: la cara que muestran al mundo. Los elementos del grupo 18, en el extremo derecho de la tabla, por ejemplo, tienen capas exteriores completamente llenas y rara vez participan en reacciones químicas.
Los elementos generalmente se clasifican como metálicos o no metálicos, pero la línea divisoria entre los dos es difusa. Los elementos metálicos suelen ser buenos conductores de electricidad y calor. Los subgrupos dentro de los metales se basan en las características y propiedades químicas similares de estas colecciones. Nuestra descripción de la tabla periódica utiliza agrupaciones de elementos comúnmente aceptados, según el Laboratorio Nacional de Los Alamos.
Metales alcalinos: Los metales alcalinos constituyen la mayor parte del Grupo 1, la primera columna de la tabla. Brillantes y lo suficientemente suaves como para cortar con un cuchillo, estos metales comienzan con litio (Li) y terminan con francio (Fr). También son extremadamente reactivos y estallarán en llamas o incluso explotarán en contacto con el agua, por lo que los químicos los almacenan en aceites o gases inertes. El hidrógeno, con su único electrón, también vive en el Grupo 1, pero el gas se considera no metálico.
Metales alcalinotérreos: Los metales alcalinotérreos forman el Grupo 2 de la tabla periódica, desde berilio (Be) hasta radio (Ra). Cada uno de estos elementos tiene dos electrones en su nivel de energía más externo, lo que hace que las tierras alcalinas sean lo suficientemente reactivas como para que rara vez se encuentren solas en la naturaleza. Pero no son tan reactivos como los metales alcalinos. Sus reacciones químicas generalmente ocurren más lentamente y producen menos calor en comparación con los metales alcalinos.
Lantánidos: El tercer grupo es demasiado largo para caber en la tercera columna, por lo que se divide y voltea hacia los lados para convertirse en la fila superior de la isla que flota en el fondo de la mesa. Estos son los lantánidos, elementos 57 a 71 - lantano (La) a lutecio (Lu). Los elementos de este grupo tienen un color blanco plateado y se manchan al contacto con el aire.
Actínidos: Los actínidos se alinean en la fila inferior de la isla y comprenden los elementos 89, actinio (Ac), hasta 103, lawrencio (Lr). De estos elementos, solo el torio (Th) y el uranio (U) ocurren naturalmente en la Tierra en cantidades sustanciales. Todos son radiactivos. Los actínidos y los lantánidos juntos forman un grupo llamado los metales de transición internos.
Metales de transición: Volviendo al cuerpo principal de la tabla, el resto de los Grupos 3 a 12 representan el resto de los metales de transición. Duros pero maleables, brillantes y con buena conductividad, estos elementos son lo que generalmente piensas cuando escuchas la palabra metal. Aquí viven muchos de los grandes éxitos del mundo del metal, incluidos el oro, la plata, el hierro y el platino.
Metales posteriores a la transición: Antes del salto al mundo no metálico, las características compartidas no están bien divididas a lo largo de líneas de grupo verticales. Los metales posteriores a la transición son aluminio (Al), galio (Ga), indio (In), talio (Tl), estaño (Sn), plomo (Pb) y bismuto (Bi), y abarcan del Grupo 13 al Grupo 17. Estos elementos tienen algunas de las características clásicas de los metales de transición, pero tienden a ser más suaves y se comportan peor que otros metales de transición. Muchas tablas periódicas presentarán una línea de "escalera" en negrita debajo del boro de conexión diagonal con astatine. Los metales posteriores a la transición se agrupan en la esquina inferior izquierda de esta línea.
Metaloides: Los metaloides son boro (B), silicio (Si), germanio (Ge), arsénico (As), antimonio (Sb), teluro (Te) y polonio (Po). Forman la escalera que representa la transición gradual de metales a no metales. Estos elementos a veces se comportan como semiconductores (B, Si, Ge) en lugar de como conductores. Los metaloides también se denominan "semimetales" o "metales pobres".
No metales: Todo lo demás en la parte superior derecha de la escalera, más hidrógeno (H), varado en el Grupo 1, no es de metal. Estos incluyen carbono (C), nitrógeno (N), fósforo (P), oxígeno (O), azufre (S) y selenio (Se).
Halógenos: Los cuatro elementos principales del Grupo 17, desde flúor (F) hasta astato (At), representan uno de los dos subconjuntos de los no metales. Los halógenos son bastante reactivos químicamente y tienden a emparejarse con metales alcalinos para producir varios tipos de sal. La sal de mesa en su cocina, por ejemplo, es una unión entre el sodio alcalino y el cloro halógeno.
Gases nobles: Incoloros, inodoros y casi completamente no reactivos, los gases inertes o nobles completan la mesa en el Grupo 18. Muchos químicos esperan que oganesson, uno de los cuatro elementos recién nombrados, comparta estas características; sin embargo, debido a que este elemento tiene una vida media que se mide en milisegundos, nadie ha podido probarlo directamente. Oganesson completa el séptimo período de la tabla periódica, por lo que si alguien logra sintetizar el elemento 119 (y la carrera para hacerlo ya está en marcha), se girará para comenzar la fila ocho en la columna de metal alcalino.
Debido a la naturaleza cíclica creada por la periodicidad que da nombre a la tabla, algunos químicos prefieren visualizar la tabla de Mendeleev como un círculo.
Adicional recursos: